Dissociation des acides faibles
L'équilibre de dissociation des acides faibles monoprotiques (qui libèrent un seul proton) en solution aqueuse sont représentés par des équations telles que :
| HA + H2O ⇌ H3O+ + A- ou, plus simplement, HA ⇌ H+ + A- | (6) |
D'une manière tout à fait générale, dans toute dissociation d'un acide ou d'une base, on aura toujours équilibre entre une forme dite acide conjugué et une forme base conjuguée qui lui est associée :
acide conjugué ⇌ base conjuguée + H+
Dans l'équilibre (6) ci-dessus, HA est la forme acide conjugué et A- la forme base conjuguée du couple acide/base HA/A-.
La constante d'équilibre Ka correspondante est donnée, en écriture simplifiée, par :
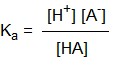 |
(7) |
Les constantes de dissociation Ka des acides faibles sont souvent des nombres inférieurs à 10-1 à 10-2 M. C'est pourquoi on a introduit une échelle logarithmique de constante de dissociation définie de manière semblable au pH :
| pKa = - log Ka soit Ka = 10-pKa | (8) |
Pour l'acide acétique CH3-COOH, Ka = 1,8 × 10-5 M, ce qui donne pKa = 4,75. La Table 2, page Concept Acide/Base, donne les valeurs des pKa de quelques acides faibles importants. Les acides ayant les pKa les plus bas sont les plus forts, les plus dissociés ; le pH de leurs solutions sont les plus faibles à une concentration donnée.