Concept d'acide et de base
Le concept généralisé d'acide et de base introduit en 1923 par J.N.Brønsted (danois) et J.M.Lowry (anglais) décrit unacidecomme un composé qui peut transférer un ou plusieurs protons vers un autre (l'eau par exemple), et unebasecomme une substance qui peut capter un ou plusieurs protons venant d'une autre substance.
Il existe des acides forts (capables de transférer totalement leur(s) protons(s), c'est-à-dire totalement dissociés en solution) et des acides faibles partiellement dissociés. De même les bases fortes sont totalement dissociées tandis que les bases faibles ne captent que partiellement le(s) proton(s). La Table 2 ci-dessous donne quelques exemples de composés appartenant à ces différentes catégories.
Table 2. Quelques acides et bases importants et leurs pKa.
ACIDES
| Forts | Faibles | pKa |
| HBr acide bromhydrique ou bromure d'hydrogène | H2CO3 acide carbonique ou carbonate d'hydrogène |
6,37 10,25 |
| HCl acide chlorhydrique ou chlorure d'hydrogène | HCN acide cyanhydrique ou cyanure d'hydrogène | 9,31 |
| HNO3 acide nitrique ou nitrate d'hydrogène | HNO2 acide nitreux ou nitrite d'hydrogène | 3,34 |
|
H2SO4 (( HSO4- + H+ acide sulfurique ou sulfate d'hydrogène |
HSO4- ⇌ SO4= + H+ hydrogénosulfate ou sulfate acide, ou bisulfate |
1,92 |
| HClO4 acide perchlorique ou perchlorate d'hydrogène | H3PO4 acide phosphorique ou phosphate d'hydrogène |
2,12 7,21 12,67 |
|
F3C-COOH acide trifluoroacétique |
CH3-COOH acide acétique ou éthanoïque |
4,75 |
|
H-COOH acide formique ou méthanoïque |
3,77 | |
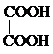 acide oxalique acide oxalique
|
1,23 4,19 |
|
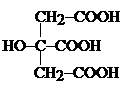 acide citrique acide citrique
|
3,14 4,77 6,39 |
BASES
| Fortes | Faibles | pKa |
| NaOH hydroxyde de sodium |
NH3 ammoniac NH4OH ammoniaque ou hydroxyde d'ammonium |
9,25 |
| KOH hydroxyde de potassium | CH3NH2 méthylamine | 10,57 |