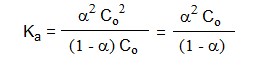Coefficient de dissociation des acides faibles
La constante de dissociation d'un acide faible peut encore s'exprimer en fonction du coefficient de dissociationα ("alpha") qui représente la fraction de mole dissociée par mole d'acide introduit ([A-]/Co = [A-]/([HA]+[A-])) :
|
HA ⇌ H+ + A- Co(1- α) Coα Coα d'où
|
(9) |
La résolution de cette équation du second degré en α permet de montrer que l'acide sera d'autant plus complètement dissocié que sa concentration Co sera faible. Ceci n'est qu'une simple conséquence de l'application du Principe de Le Châtelier de déplacement des équilibres : plus la concentration est faible, plus l'équilibre est déplacé dans le sens d'une augmentation du nombre de particules, c'est-à-dire dans le sens de la dissociation. La racine de l'équation (9) fournit en effet la valeur de α en fonction de la concentration Co :
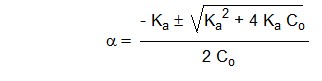 |
(10) |
où α doit toujours être un nombre positif. Quelques valeurs typiques de α à différentes concentrations, pour un acide faible de Ka = 10-5 (pKa = 5) sont reprises dans la Table 3.
Table 3. Coefficients de dissociation d'un acide faible monoprotique de pKa = 5
| Co (M) | 0,1 | 0,001 | 10-5 |
| α | 1 % | 9,5 % | 62 % |